Современные классификационные аспекты диагностики и тактики лечения острого холецистита и холангита
Острый холецистит (ОХ) – заболевание чрезвычайно частое. Это одна из актуальнейших проблем, обсуждаемая с конца прошлого столетия до сегодняшних дней. Количество осложненных форм острого холецистита достигает 35% и не имеет тенденции к уменьшению. Сегодня около половины всех больных, поступающих в хирургический стационар с острым холециститом, подвергаются экстренным или срочным операциям.
Острый холецистит (ОХ) – заболевание чрезвычайно частое. Это одна из актуальнейших проблем, обсуждаемая с конца прошлого столетия до сегодняшних дней. Количество осложненных форм острого холецистита достигает 35% и не имеет тенденции к уменьшению. Сегодня около половины всех больных, поступающих в хирургический стационар с острым холециститом, подвергаются экстренным или срочным операциям.
Операционная травма, высокий
Холецистэктомия из
Токийское руководство
В 2007 году было опубликовано Токийское руководство (The Tokyo Guidelines — TG) по тактике диагностики и оценке тяжести острого холангита и холецистита. В основу классификации легли результаты сопоставления клинической и морфологической картины 451 случая заболевания острым холециститом. Авторы указывают на высокую чувствительность (91,2%) и специфичность (96,9%) выделенных критериев, которые представлены в таблицах 1 и 2 (в пересмотре от 2013 года — TG13).
Таблица 1. TG13 диагностические критерии острого холецистита
|
A. Местные признаки воспаления (1) симптом Мерфи, (2) тяжесть / боль / инфильтрат в правом подреберье Б. Системные признаки воспаления (1) Лихорадка, (2) повышение уровня СРБ, (3) повышение уровня лейкоцитов С. Методы визуализации: Результаты обработки изображений, характерных для острого холецистита Предполагаемый диагноз: Один из пунктов в A + один из пунктов в B Окончательный диагноз: Один из пунктов в A + один из пунктов в B + С |
| Должны быть исключены: Острый гепатит, другие острые заболеваний органов брюшной полости, и хронический холецистит. |
Авторы сообщают о малой чувствительности и специфичности самого симптома Мерфи, а также то, что определение уровня СРБ не является часто применимым тестом в повседневной хирургической практике. Вместе с тем, в рамках приведенной классификации эти показатели дают хороший прогностический результат.
Таблица 2. TG13 критерии оценки тяжести острого холецистита
| III степень (тяжелая) острого холецистита связана с недостаточностью любой из следующих органов / систем | |
|
1. |
Гипотония, требующая лечения допамином ≥ 5 мг/кг в минуту, или любой дозой норадреналина |
| 2. Нарушения со стороны нервной системы | Снижение уровня сознания |
| 3. Дыхательная недостаточность | PaO2/FiO2 < 300 |
| 4. Почечная недостаточность | Олигурия, креатинин > 2,0 мг/дл |
| 5. Печеночная недостаточность |
|
| 6. Гематология | Уровень тромбоцитов < 100 000/мм3 |
| II степень (средняя) острого холецистита связана с любым из следующих условий | |
|
1. Увеличение числа лейкоцитов > 18 000/мм3 2. Пальпируемый инфильтрат в правом подреберье 3. Продолжительность болезни > 72 часов 4. Местное воспаление (гангренозный холецистит, перивезикальный абсцесс, абсцесс печени, желчный перитонит, эмфизематозный холецистит) |
|
| I степень (легкая) острого холецистита характеризуется отсутствием критериев из III или II степени острого холецистита. Легкая степень характеризуется легкими воспалительными изменениями в желчном пузыре, определяется как острый холецистит без дисфункции органов, что делает холецистэктомию безопасной оперативной процедурой с низким уровнем риска. | |
В данной классификации, а также во многих отечественных и зарубежных руководствах и монографиях указан лимит для принятия решения о хирургическом вмешательстве — 72 часа. С другой стороны, тактика ведения пациентов с острым холециститом в г. Москве регламентируется приказом Департамента здравоохранения г. Москвы № 320 от 13 апреля 2011 года «О единой тактике диагностики и лечения острых хирургических заболеваний органов брюшной полости в
То есть, с одной стороны, приказом поддерживается соблюдение
Вместе с тем, раннее радикальное лечение ОХ при компенсации функций органов и систем пациента предпочтительнее, чем проведение двух- и более этапного лечения.
Среди последних публикаций обращает на себя внимание исследование Gutt CN, Encke J, Köninger J, et al (Acute Cholecystitis: Early Versus Delayed Cholecystectomy, A Multicenter Randomized Trial // Ann Surg. 2013; 258. p. 385–393). На примере анализа 618 холецистэктомий, выполненных в первые 24 часа после поступления, а также в период с 7 до 45 дней, авторы доказывают безопасность и целесообразность проведения ранних радикальных вмешательств. Кроме этого, по данным TG13, использование эффективной классификации ОХ делает безопасным и расширяет временные границы для радикального хирургического лечения в пределах 72 часов.
Предпосылки для создания специфической системы оценки тяжести состояния больных острым холециститом
Одной из основных проблем при определении тактики в отношении больных ОХ является оценка общесоматического состояния больного, а также состояния, вызванного самим приступом ЖКБ.
Достаточной простым решением данного вопроса, на первый взгляд, может стать применение оценки физического состояния пациента по классификации американского общества анестезиологов (American Society of Anaesthesiologists) — ASA:
Класс I — пациенты без органических, физиологических, биохимических и психических расстройств.
Класс II — слабые или умеренные системные расстройства, связанные или не связанные с предстоящим хирургическим вмешательством.
Класс III — выраженные системные расстройства, связанные или не связанные с предстоящим хирургическим вмешательством.
Класс IV — выраженные системные расстройства, несущие угрозу жизни как в связи с хирургическим вмешательством, так и без него.
Класс V — умирающие пациенты с невысокой вероятностью выжить, у которых хирургическое вмешательство рассматривается в качестве последнего шанса.
Класс VI — пациенты со смертью головного мозга, доноры органов.
Если пациенту предстоит срочная операция, к цифре соответствующего класса добавляется символ
I класс не вызывает больших вопросов, так как речь идет о молодых и/или практически здоровых пациентах. Конечно, можно указать на казуистические случаи смерти на фоне видимого благополучия и пр., но для определения тактики на общепопуляционном уровне это не имеет существенного значения.
Класс II уже вызывает некоторые сомнения, так как в нем заключены уже 4 группы пациентов:
1. Слабые системные расстройства, связанные с предстоящим хирургическим вмешательством;
2. Слабые системные расстройства, не связанные с предстоящим хирургическим вмешательством;
3. Умеренные системные расстройства, связанные с предстоящим хирургическим вмешательством;
4. Умеренные системные расстройства, не связанные с предстоящим хирургическим вмешательством.
Возникает дилемма: имеет ли клинический смысл выделение данных категорий пациентов, или же это не влияет на исход хирургического лечения?!
С прогностической точки зрения разработано множество шкал оценки вероятности наступления летальности. В хирургии наиболее валидными оказались SOFA — (
Конечно, можно возразить, что пациенты с органной недостаточностью должны находиться в ОРИТ, где такие проблемы не возникают, однако наибольший интерес вызывают пациенты с пограничными состояниями, которым при определенных условиях и должной подготовке можно выполнить радикальное хирургическое лечение в оптимальные для них сроки. Именно в этом состоит основной смысл создания хирургической классификации тяжести состояния больных ОХ.
То есть, с одной стороны, существующие на данный момент классификации тяжести состояния хирургических больных либо неконкретны, как ASA, либо слишком громоздки и требуют специальных исследований, которые практически не доступны для общехирургического отделения.
Прикладная оценка токийских рекомендаций
Рассматривая Токийскую классификацию, можно сделать вывод, что несмотря на свою простоту, она вмещает в себя как общесоматические, так и специфические для обострения ЖКБ параметры. Причем стадии распределены в зависимости от степени анестезиологического риска: от минимального
Степень тяжести
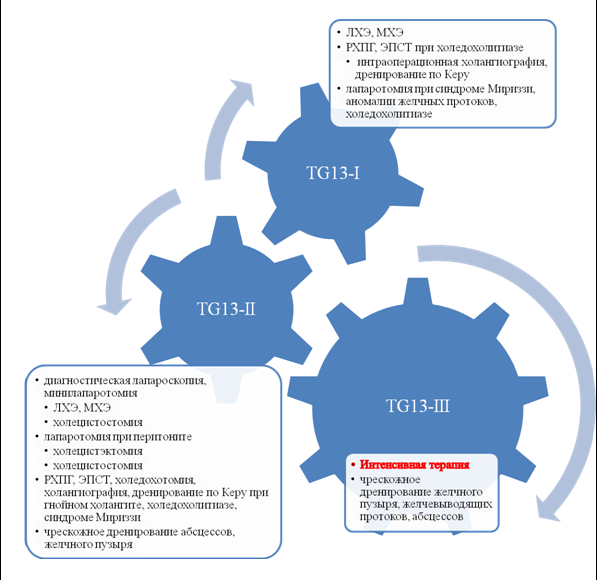
Таким образом, тактика ведения больных с острым холециститом может свестись к очень простой схеме. Если до 72 часов у пациента I степень тяжести по TG13, проводится радикальная операция. Как «золотой стандарт» — ЛХЭ, резерв — МХЭ.
При наличии холедохолитиаза, а также при синдроме Мириззи, необходимо проведение предоперационной ретроградной холангиопанкреатографии (РХПГ), эндоскопической папиллосфинктеротомии (ЭПСТ), а также интраоперационной холангиографии, при эндоскопической неудачной литэкстракции — холедохотомии. Синдром Мириззи часто требует проведения лапаротомии, ЭПСТ малоэффективна. Вмешательство заканчивается наружным дренированием желчевыводящих протоков. Дренажи удаляются на 17–21 сутки при отсутствии клинических и рентгенологических признаков нарушения проходимости протоков.
Если до 72 часов у пациента степень тяжести ОХ
Если до 72 часов органная недостаточность (
Если по
Тактика при
При
Во всех спорных случаях при отсутствии
Одним из моментов, который не упомянут в TG13, является ситуация с наличием желтухи. С одной стороны, такое состояние можно трактовать как осложнение ЖКБ и присвоить II степень тяжести ОХ. С другой стороны, изменения в желчном пузыре чаще носят вторичный катаральный характер, поэтому отодвигаются на второй план. Вместе с тем, наличие желтухи вносит неблагоприятный вклад в результаты радикального хирургического лечения ЖКБ, поэтому условно данное состояние можно назвать развитием печеночной недостаточности, таким образом, выставляя III степень тяжести по TG13. Это себя оправдывает, так как такие паллиативные мероприятия как ЭПСТ, чрескожное дренирование желчевыводящих протоков и желчного пузыря являются лечебными при данном состоянии. Холецистэктомия возможна в отсроченном порядке после купирования желтухи. Схематично клиническая интерпретация TG13 представлена на рисунке 1.
Рисунок 1. Тактика лечения острого холецистита согласно Токийскому руководству TG13
Использование токийских рекомендаций в собственной практике
В собственной работе мы провели исследование результатов 102 холецистэктомий с использованием малотравматичных технологий МХЭ и ЛХЭ, в том числе так называемых «гибридных» лапароскопических операций, выполненных у больных с острым холециститом в сочетании с грыжами живота. Для сравнения результатов лечения была отобрана контрольная группа из 117 пациентов, перенесших ТХЭ. В эту группу вошли больные, оперированные по срочным показаниям без
Нам не удалось выявить патогномоничных клинических симптомов для отбора больных МХЭ, ЛХЭ или ТХЭ,
Были выделены следующие критерии отбора для выполнения МХЭ:
-
Пациенты с ОХ и давностью заболевания не более 72 часов без
клинико-инструментальных данных о поражении внепеченочных желчных протоков и парапузырных осложнений. -
При давности заболевания более 72 часов, если нет
клинико-лабораторных и инструментальных данных за парапузырные осложнения (при наличии развивающихся осложнений вопрос решался индивидуально с учетом противопоказаний к МХЭ). -
При наличии поражений внепеченочных желчных протоков, которые не были устранены на дооперационном этапе, с давностью заболевания не более 72 часов и отсутствии парапузырных осложнений.
-
При наличии поражения внепеченочных протоков с давностью заболевания более 72 часов, если нет ультразвуковых признаков парапузырных осложнений.
-
Пациенты с повышенным
операционно-анестезиологическим риском (ОАР), когда имеются противопоказания для применения эндотрахеального наркоза, но возможно использование ЦСБ (центрального сегментарного блока с сохранением внешнего дыхания). -
При наличии противопоказаний к ЛХЭ и отсутствии их к МХЭ.
Критерии отбора для выполнения ЛХЭ:
-
Пациенты с ОХ и давностью заболевания не более 72 часов без
клинико-инструментальных данных за поражения внепеченочных желчных протоков. -
При давности заболевания более 72 часов, если нет УЗ признаков парапузырных осложнений.
-
Пациенты с ожирением
III–IV степени, низком расположении края печени, когда доступ, применяемый при МХЭ, не позволяет обеспечить необходимый операционный обзор. -
При подозрении на ОХ, когда с целью уточнения диагноза операция начинается с диагностической лапароскопии и может быть закончена ЛХЭ.
-
Наличие послеоперационных вентральных или пупочных грыж размерами 6–7 см в сочетании с ОХ (Показанием к
«мануально-ассистированной» холецистэктомии). -
При наличии противопоказаний к МХЭ и отсутствии их к ЛХЭ.
Консервативную терапию проводили согласно городскими стандартами г. Москвы. В состав терапии включались антибактериальные препараты широкого спектра, спазмолитики, противовоспалительные препараты, инфузии солевых растворов. Сопутствующие заболевания корригировались со специалистами смежных профессий и дополняли консервативную терапию.
Показанием к холецистэктомии миниинвазивными методами являлось отсутствие положительной динамики на фоне консервативного лечения в течение 12–24 часов.
Под положительной динамикой считали следующее:
-
Наличие УЗ признаков уменьшения толщины и отсутствие слоистости стенок желчного пузыря, сокращение размеров желчного пузыря, миграция конкремента из шейки желчного пузыря.
-
Снижение воспалительных изменений в периферической крови при повторных лабораторных исследованиях.
-
Клиническое улучшение на фоне консервативной терапии.
-
Наличие фиксированного конкремента в шейке желчного пузыря и отсутствии его миграции на фоне проводимой консервативной терапии даже при
клинико-лабораторных признаках купирования приступа ОХ. -
Бескаменный ОХ у пациентов пожилого и старческого возраста, поскольку в большинстве случаев имеет место тромбоз сосудов желчного пузыря, а консервативная терапия является неэффективной.
На основании углубленного ретроспективного анализа мы определили, что 23,5% пациентов поступают в стационар позже 48 часов. Суммируя к этому еще и время, которое нужно для обследования, проведения консервативной терапии и подготовки пациента к оперативному вмешательству, можно заключить следующее: в основной группе в 29,4% случаев больные оперировались в сроки позднее 72 часов, а в 70,6% — в сроки 48–72 часа. Следовательно, декларируемая в литературе
В группе сравнения по срочным показаниям при неэффективности консервативной терапии в течение до 24 часов оперировано 15 (12,8%) больных, в сроки 24–72 часа — 58 (49,6%), а позже 72 часов — 44 (37,6%).
Продолжительность операции в обеих группах больных оказалась: 78,5 ± 24,1 мин. при МХЭ, 78,5 ± 29,5 мин. при ЛХЭ и 62,7 ± 17,7 мин. при ТХЭ (р = 0,006). При этом технические трудности, возникшие во время оперативного вмешательства, достоверно не зависели от формы воспаления желчного пузыря, а зависели от парапузырных осложнений в области шейки желчного пузыря. При изучении парапузырных осложнений и конверсии доступа в зависимости от сроков заболевания показано, что основной причиной конверсии являлся плотный парапузырный инфильтрат, который достоверно больше встречается у больных, оперированных после 72 часов.
Различия в частоте интраоперационных осложнений при выполнении малотравматичных ХЭ и ТХЭ оказались недостоверны — 8,8% и 4,27%, соответственно (р > 0,05). Из девяти (8,8%) осложнений, возникших в основной группе, восемь (7,8%) не потребовали расширения доступа и устранены интраоперационно. В одном случае (кровотечение из культи пузырной артерии) потребовало конверсии доступа. Кроме того, при необходимости, в зависимости от сопутствующей хирургической патологии, требующей оперативной коррекции, можно выполнить ХЭ с помощью малотравматичных методов. Поражение внепеченочных желчных путей устраняли двухэтапным методом: выполняли ЭРХПГ и ЭПСТ, после извлечения конкремента выполняли ХЭ малотравматичными методами. Если не удавалось устранить патологию на дооперационном периоде, применяли МХЭ с последующей интраоперационной холангиографией. В основной группе таких пациентов было четыре (3,9%). Еще в одном (0,98%) случае интраоперационной находкой было сочетание
Благодаря малотравматичности МХЭ, у 18 (17,6%) больных использовали в качестве анестезиологического обеспечения перидуральную анестезию. Все больные имели тяжелые сопутствующие заболевания и противопоказания для применения эндотрахеального наркоза (ЭТН). Сопутствующие заболевания корригировались на дооперационном периоде, и после стабилизации состояния пациента применяли МХЭ под перидуральной анестезией. В одном случае
В раннем послеоперационном периоде лучшие результаты оказались в основной группе больных. Так, количество послеоперационных осложнений (любое отклонение от гладкого течения послеоперационного периода) в основной группе составило 15 (14,7%), а в контрольной — 30 (25,5%) (р < 0,05). Причем в контрольной группе количество осложнений было больше как за счет осложнений со стороны послеоперационной раны и зоны операции, так и за счет осложнений, обусловленных обострением хронических заболеваний или декомпенсацией сопутствующих
Тяжелых осложнений, потребовавших релапаротомии, в основной группе не было, в группе сравнения было два (1,7%). У одного пациента (0,85%) — эвентерация, еще у одного в раннем послеоперационном периоде имелись признаки желчного перитонита и ранней спаечной кишечной непроходимости.
После ХЭ из малотравматичных доступов потребность в обезболивании наркотическими анальгетиками составила 2,37 ± 1,2 мл 2% промедола в течение 1,19 ± 0,45 суток, тогда как после ТХЭ — 4,4 ± 1,73 мл в течение 1,87 ± 0,9 суток (р < 0,05). Функция кишечника (отхождение газов) у пациентов основной группы восстановилась через 1,5 ± 0,8 суток, в контрольной группе — через 3,5 ± 1 сутки (р < 0,05). Активизация больных (больным разрешено передвигаться в пределах палаты и по коридору отделения) в основной группе происходила через 1,5 ± 0,5 суток, в контрольной — 2,0 ± 0,5 суток (р < 0,05). Длительность послеоперационного госпитального периода в основной группе в среднем составила 4 ± 1,15 суток, в контрольной группе — 12,14 ± 1,4 суток (р < 0,05). Следует отметить, что выписка пациента на амбулаторное лечение после МХЭ при отсутствии осложнений возможна уже на 3–4 сутки, однако в связи с существующими
С целью определения оптимальных сроков для успешного выполнения холецистэктомии из малотравматичных доступов нами был проведен анализ всех случаев конверсии доступа. В результате исследования установлено, что наиболее частыми причинами расширения операционной раны стали:
-
выраженный спаечный процесс и плотный инфильтрат в подпеченочном пространстве (7 пациентов);
-
кровотечение из культи желчного пузыря в условиях выраженных воспалительных изменений (1 пациент);
-
атипичное строение элементов треугольника Кало и трудности дифференциации в условиях инфильтрата (1 пациент).
На основании анализа мы пришли к выводу, что необходимость в конверсии доступа во многом зависит как от операционной ситуации в каждом конкретном случае, так и от опыта оперирующего хирурга. Наибольшее количество конверсий (7 случаев) пришлось на период освоения метода, в позднем периоде нашей работы число конверсий доступа значительно сократилось. Более того, в процессе совершенствования оперативной техники парапузырные осложнения не всегда являлись показанием к конверсии. Все конверсии, кроме одной (0,98%), были выполнены в сроки после 72 часов от начала заболевания. В последующем для уменьшения количества парапузырных осложнений и неоправданного затягивания консервативной терапии мы старались придерживаться более активной хирургической тактики лечения
Таким образом, мы считаем, что оптимальным сроком для выполнения ХЭ из малотравматичных доступов при ОХ без
Таким образом, на основании обобщенных данных литературы и собственных результатов, ХЭ из малотравматичных доступов может быть противопоказана в следующих случаях:
-
деструктивный холецистит с развитием диффузного перитонита;
-
необходимость корригировать оперативным путем другие хирургические заболевания из широкого лапаротомного доступа, если этого невозможно выполнить лапароскопическим путем;
-
воспалительные изменения тканей передней брюшной стенки;
-
выраженные
рубцово-инфильтративные изменения в области шейки желчного пузыря ипеченочно-двенадцатиперстной связки и плотный инфильтрат; -
общие противопоказания при ЛХЭ и МХЭ (нарушение свертываемости, портальная гипертензия, поздние сроки беременности
и т. д. ).
С приобретением достаточных навыков операции из
Со временем нам удалось улучшить полученные результаты, сократив средние сроки госпитализации при проведения малоинвазивных вмешательств до 3–5 суток. Также сокращены сроки принятия решения о хирургическом лечении до 12 часов.
Заключение
Выполненные по строгим показаниям МХЭ либо ЛХЭ сопровождаются незначительным числом осложнений, большинство из которых не являются тяжелыми, сокращаются сроки пребывания больных в стационаре, достигается хороший косметический эффект, больные раньше возвращаются к прежнему социально активному образу жизни. Все вышеперечисленные преимущества позволяют рекомендовать МХЭ и ЛХЭ для более широкого внедрения в клиническую практику при лечении больных острым холециститом.
Литература
Черепанин А. И., Луцевич О. Э., Галлямов Э. А., Поветкин
Gutt CN, Encke J, Köninger J, et al (Acute Cholecystitis: Early Versus Delayed Cholecystectomy, A Multicenter Randomized Trial // Ann Surg. 2013; 258: p. 385–393.
Yokoe M. et al. New diagnostic criteria and severity assessment of acute cholecystitis in revised Tokyo guidelines // J HepatobiliaryPancreat Sci. — 2012. — 19. p. 578–585.
Yokoe M. et al. TG13 diagnostic criteria and severity grading of acute cholecystitis (with videos) // J HepatobiliaryPancreat Sci. — 2013. — 20. p. 35–46.