Новый подход к применению генно-инженерных биологических препара-тов при системной красной волчанке
Цель: определить эффективность двойной анти-В-клеточной терапии у пациентов с активной системной красной волчанкой (СКВ).
Методы: наблюдались три пациента с достоверной СКВ, которые получали ритуксимаб (РТМ) в дозе 500–1000 мг, через три месяца после окончания инфузий РТМ назначался белимумаб (БЛМ) из расчета 10 мг/кг один раз в месяц, всего восемь инфузий. Срок наблюдения – один год. Исходно и затем каждые три месяца проводилась оценка эффективности и переносимости терапии, концентрация аутоантител, комплемента и субпопуляций В-лимфоцитов.
Результаты: на фоне двойной анти-В-клеточной терапии наблюдалось значительное клиническое улучшение, не отмечалось признаков рецидива СКВ за весь период наблюдения, достигнута нормализация уровня лабораторных маркеров активности заболевания (концентрация антител к нативной (н) ДНК, С3,С4 компонентов комплемента), а также стойкая деплеция аутореактивных В-лимфоцитов, в частности плазматических клеток. У всех пациентов удалось снизить дозу глюкокортикоидов (ГК) до 7,5 мг/сутки в пересчете на преднизолон ко второму месяцу после завершения терапии.
Заключение: двойная анти-В-клеточная терапия является новым перспективным методом лечения активной СКВ. Применение такой схемы способствует быстрому подавлению активности заболевания и длительному сохранению полученного эффекта, уменьшению риска развития тяжелых необратимых органных повреждений за счет снижения дозы ГК до минимальной.
Введение
В течение нескольких десятилетий основным методом лечения СКВ оставалось назначение глюкокортикоидов (ГК) и цитостатиков (ЦТ). Применение комбинированной терапии ГК и ЦТ способствовало уменьшению частоты рецидивов, увеличению продолжительности жизни и значительному снижению ранней и поздней летальности [1]. Однако, несмотря на изменение характера течения СКВ и улучшение жизненного прогноза, назначение массивных доз ГК для купирования обострения и многолетнее применение средних доз с целью поддержания низкой активности привело к нарастанию числа необратимых органных повреждений и значительному снижению качества жизни больных [2, 3]. В 2014 году группой ведущих ревматологов мира была сформулирована концепция современной терапии СКВ, целью которой является не только увеличение продолжительности жизни, но и достижение ремиссии/минимальной активности, предотвращение развития необратимых органных повреждений, улучшение качества жизни, миниминизация дозы ГК, а при возможности их полная отмена [4, 5]. В связи с этим заманчивые перспективы «стероидозамещения» открывает эра генно-инженерных биологических препаратов (ГИБП). Первым ГИБП, с успехом применяемым в лечении СКВ, является Ритуксимаб (РТМ), назначение которого при высокой активности, поражении центральной нервной системы (ЦНС) и наличием нефрита оказалось высоко эффективным и мало токсичным [6, 7]. В 2010 году после завершения клинических исследований комиссией по пищевым продуктам и лекарственным препаратам (FDA США) был зарегистрирован Белимумаб (БЛМ) – первый ГИБП, разработанный для лечения СКВ [8]. Результаты клинических исследований и данные применения БЛМ в реальной клинической практике позволяют рекомендовать этот препарат для лечения больных СКВ с высокой и средней степенью активности, с преимущественным поражением суставов, кожи, слизистых и серозных оболочек, с высокой иммунологической активностью. Терапия БЛМ обеспечивает не только подавление активности, но и стойкую ремиссию или низкую активность, а также возможность максимального снижения ежедневной дозы и даже отмены ГК [9, 10, 11].
Таким образом, важным элементом в совершенствовании терапии СКВ является разработка наиболее эффективных методов лечения, ориентированных не только на продление жизни больных, но и улучшение ее качества, восстановление активности и работоспособности пациента. Для выполнения поставленных задач существуют два пути – создание новых таргетных препаратов и формирование принципиально новых схем терапии. Такая схема может включать последовательное применение двух ГИБП – быстрое снижение активности СКВ с помощью РТМ с последующим назначением БЛМ с целью поддержания эффекта и достижения ремиссии.
Перспективы такого лечения могут быть раскрыты благодаря детальному изучению механизмов действия препаратов и особенностей патогенетических факторов (субпопуляций В-лимфоцитов, BLyS), на которые ориентирован каждый ГИБП. Так, известно, что у больных СКВ после применения РТМ, как правило, развивается деплеция B-лимфоцитов (CD20) с последующим существенным повышением в сыворотке крови концентрации BlyS (BAFF) – основной мишени для БЛМ [12]. В недавно опубликованной работе L. M. Carter и соавт. [13] установлено, что после терапии РТМ наблюдается повышение уровня BAFF, полученные данные служат теоретическим обоснованием для проведения двойной анти-В-клеточной терапии у больных СКВ.
Мы представляем описание случаев комбинированной анти-В-клеточной терапии у трех пациенток с СКВ высокой степени активности, которые наблюдались в клинике ФГБНУ НИИР им. В. А. Насоновой. На первом этапе в качестве индукционной терапии назначался РТМ 1000 мг с последующим (через три месяца) переходом на поддерживающее лечение БЛМ по стандартной схеме 10 мг/кг один раз в месяц, в течение восьми месяцев. Срок наблюдения составил один год. При поступлении и на каждом визите оценивалась активность СКВ по SLEDAI-2K по следующему принципу: нет активности (SLEDAI 0 баллов), низкая (SLEDAI 1–5 баллов), средняя (SLEDAI 6–10 баллов), высокая (SLEDAI 11–19 баллов) и очень высокая активность (SLEDAI более 20 баллов), определялся индекс повреждения SLICC (ИП SLICC). Исходно и затем каждые три месяца всем пациенткам проводилось стандартное исследование общего анализа мочи, крови, иммунологических маркеров СКВ (антинуклеарного фактора (АНФ), антител (ат) к нДНК, С3 иС4 компонентов комплемента), а также специфическое исследование субпопуляций В-лимфоцитов в лаборатории иммунологии и молекулярной биологии ревматических заболеваний ФГБНУ НИИР им. В. А. Насоновой. Субпопуляции В-клеток определялись методом многоцветной проточной цитофлуорометрии с использованием панели моноклональных антител к поверхностным мембранным маркерам В-лимфоцитов. Оценку результатов четырехцветного окрашивания В-лимфоцитов проводили на проточном цитофлуориметре Beckman Coulter NAVIOS (Beckman Coulter, США). Для каждого анализа подсчитано 50 000 событий. B-клеточные популяции идентифицировали c помощью программного обеспечения CXP (Beckman Coulter, США). При гейтировании по горизонтальной и вертикальной осям определяли процентное содержание лимфоцитов (CD45+) и В-клеток (CD19+), а на основании экспрессии поверхностных мембранных маркеров IgD, CD20, CD27, CD38, CD10 и CD138 проводили количественное измерение субпопуляций В-клеток (табл. 1) [14].
Таблица 1. Молекулярные маркеры субпопуляций В-лимфоцитов
| Субпопуляции В-лимфоцитов | Молекулярные маркеры | Норма, % |
Норма, Х109/л |
| В-лимфоциты CD 19+ | CD19+ | 8,7 [3,4–14,3] | 0,2 (0,1–0,3) |
| Наивные (зрелые) В-лимфоциты | CD19+CD27-IgD+ | 64,5 [51,0–78,9] | 0,1 [0,03–0,2] |
| В-клетки памяти | CD19+CD27+ | 2,2 [0,6–4,7] | 0,004 (0,0004–0,01) |
| «Непереключенные» В-клетки памяти | CD19+CD27+IgD+ | 8,4 [2,1–27,9] | 0,01 [0,003–0,06] |
| «Переключенные» В-клетки памяти | CD19+CD27+IgD- | 13,6 [4,3–27,1] | 0,02 [0,01–0,1] |
| Плазматические клетки | CD19+CD38+ | 0,1 [0,003–0,2] | 0,0001 [0–0,0003] |
| Плазмобласты | CD19+СD38+++IgD-CD27+CD20- | 0,2 [0,1–0,7] | 0,0003 [0,0001–0,001] |
| Транзиторные В-клетки | CD19+IgD+CD10+CD38++CD27- | 0,07 [0–0,2] | 0,0001 [0–0,0005] |
| Двойные негативные В-клетки | CD19+CD27-IgD- | 13,7 [3,7–29,8] | 0,02 [0,01–0,1] |
Пациентка Ф, 20 лет, поступила в клинику ФГБНУ НИИР им. В. А.Насоновой с диагнозом: «СКВ хронического (по началу) течения, высокой степени активности (SLEDAI2K-1) 6 баллов, с поражением кожи (эритематозные высыпания, эритема Гатчинсона), слизистых (множественное язвенное поражение слизистой мягкого, твердого неба, щек, губ, энантема, хейлит), генерализованный кожный и дигитальный васкулит (оскольчатые геморрагии, яркие ладонные, подошвенные капилляриты, синдром Рейно), полисерозиты (экссудативный перикардит, плеврит), иммунологические нарушения (ат к нДНК, снижение уровня С3, С4 компонентов комплемента), АНФ (+).ИП SLICC/ACR -1 (плевральный фиброз); синдром Шегрена, паренхиматозный паротит, выраженной стадии».
Сопутствующее заболевание: хронический пиелонефрит.
Заболела в 2011 году (в возрасте 16 лет), когда появились боли в суставах кистей, коленных, локтевых суставах, лихорадка до 39С, лимфаденопатия, что послужило поводом для госпитализации. При обследовании выявлена эритема в зоне бабочки, ладонные и подошвенные капилляриты, лимфаденопатия, экссудативный перикардит; ат к нДНК > 45 МЕ/мл (норма 0–20 МЕ/мл), АНФ (+), антитела к Ro (aт-Ro) > 600 Ед/мл (норма 0–25 Ед/мл), уровень антител к циклическому цитруллинированному пептиду (АЦЦП) в пределах нормы, гемоглобин (Нв) 102 г/л, С-реактивный белок (СРБ) 53 мг/л (норма 0–5 мг/л), ревматоидный фактор (РФ) 586 МЕ/мл (норма 0–15 МЕ/мл), госпитализирована в ревматологическое отделение НЦЗД РАМН в июле 2011года. Проводилось лечение: преднизолон 50 мг/сутки,пульс-терапия метипредом (суммарно 4,0 г), интраглобин 25 г, микофенолата мофетил (ММ) 2 г/сутки. На фоне терапии нормализовалась температура, уменьшилась выраженность артралгий, перикардита, проявлений капилляритов. После выписки дозу преднизолона постепенно снизила до 10 мг/сутки, продолжала прием ММ 2 г/сутки. В дальнейшем состояние оставалось удовлетворительным, жалоб не предъявляла.
Для уточнения диагноза в феврале 2013 года впервые консультирована в ФГБНУ НИИР им В. А. Насоновой, диагноз СКВ подтвержден, выявлен сопутствующий синдром Шегрена (паренхиматозный паротит, выраженной стадии). В анализах: АНФ 1/640 h+sp, С4 0,09 г/л (норма 0,1–0,4 г/л), С3 0,96 г/л (норма 0,9–1,8 г/л) aт-Ro > 200 Ед/мл, антитела к La (aт-La) 53.3 Ед/мл(норма 0–25 Ед/мл), РФ 44,9 МЕ/мл, криоглобулины 2+, ат к нДНК > 300 МЕ/мл, СРБ < 0,15 мг/л. Самочувствие оставалось удовлетворительным. Доза ММ была снижена до 1000 мг/сутки, добавлен гидроксихлорохин (ГХ) 200 мг/сутки, продолжала прием преднизолона.
В декабре 2013 года обострение СКВ – высокая иммунологическая активность (ат к нДНК > 300 МЕ/мл, РФ 68,7 МЕ/мл, АНФ 1/1280 h+sp), артралии, субфебрилитет, анемия. Обсуждался вопрос о присоединении к лечению ГИБП, однако наличие обострения хронического пиелонефрита (лейкоцитурия, бактериурия) не позволило провести такую терапию. Пациентка выписана с рекомендациями – продолжить прием преднизолона 10 мг/сутки, ММ 1500 мг/сутки, ГХ 400 мг/сутки. В связи с неэффективностью терапии ММ (по амбулаторной карте), препарат был отменен, к лечению добавлен азатиоприн 150 мг/сутки, который больная принимала в течение четырех месяцев (на фоне приема препарата развивается пятнисто-папулезная сыпь, что послужило поводом для отмены). В это же время впервые в общем анализе мочи (ОАМ) обнаружен белок 0,7г/л –1,7 г/л; лейкоцитурия 4–8 п/з, от госпитализации пациентка отказалась.
В августе 2014 года – появление эритематозных высыпаний в области декольте, спины, плеч, энантемы твердого и мягкого неба, что послужило поводом для повторного обращения в ФГБНУ НИИР им. В. А. Насоновой. Доза преднизолона увеличена с 10 до 30 мг/сутки, ГХ 200 мг/сутки, возобновлен прием ММ 2000 мг/сутки, назначен лозап 25 мг/сутки. В связи с высокой клинической и иммунологической активностью вновь обсуждался вопрос о назначении ГИБП, но терапия была отложена в связи с обострением хронического пиелонефрита. Однак, в связи с сохраняющейся высокой активностью СКВ после курса антибактериальной терапии и полного купирования симптомов мочевой инфекции, проведены пять сеансов плазмафереза с синхронным введением после каждой процедуры солумедрола (500–500–250–250–250 мг соответственно), с кратковременным эффектом. Несмотря на проведение активной терапии (преднизолон 30 мг/сутки, ГХ 200 мг/сутки, ММ 2000 мг/сутки), прогрессировал генерализованный кожный и дигитальный васкулит (с поражением кожи лица, декольте, спины, плеч, ушей, стоп, ладоней), с образованием в области пальцев изъязвлений. Пациентка госпитализирована в клинику ФГБНУ НИИР им. В. А. Насоновой. При обследовании отмечена высокая иммунологическая активность АНФ 1/640, ат к нДНК 36,3 МЕ/мл, гипокломплементемия, В-лимфоциты –14,4%, повышение процентного и абсолютного количества наивных В-клеток (69% – 0,2 Х 109/л), двойных негативных В-лимфоцитов памяти (40,4% – 0,1 абс. кол-во), в меньшей степени плазматических клеток (11,3% – 0,03 абс. кол-во). Общая активность заболевания по SLEDAI-2K-16 баллов, в связи с чем 31 октября 2014 года инициирована терапия РТМ 1000 мг с премедикацией солумедролом 125 мг и последующим назначением дексаметазона 36 мг (суммарно 144 мг) и циклофосфана (ЦФ) 800–400–200мг (суммарно 1400 мг) в течение четырех дней с перерывом в один – два дня. На фоне проводимой терапии достигнута полная деплеция В-лимфоцитов. Значительно уменьшены явления васкулита.
С декабря 2014 года по апрель 2015 года доза преднизолона снижена с ПЗ с 25 мг до 15 мг в сутки, ежемесячно получала инфузии ЦФ в дозах 400–600 мг. Активность заболевания не нарастала, однако полностью купировать симптомы СКВ не удавалось: васкулит, эритематозные высыпания в области лица, живота, спины, энантемы слизистых и иммунологические изменения сохранялись (АНФ 1/640 h+sp, С3-0,41 г/л, С4-0,058 г/л, криопреципитины+3), SLEDAI-2K-14 баллов.
С января 2015 года (через три месяца после введения РТМ) на фоне терапии преднизолоном 15мг/сутки и ежемесячных инфузий ЦФ по 400–600 мг инициирована терапия БЛМ по стандартной схеме с премедикацией солумедролом (250 мг за инфузию). К девятому месяцу наблюдалась репопуляция В-лимфоцитов преимущественно за счет «переключенных» (55,9% – 0,002 x109/л) и двойных негативных В-клеток памяти (11,8% – 0,0005 x109/л), наивных В-лимфоцитов (29,4% – 0,001 x109/л), а к девнадцатому месяцу также возросла доля «непереключенных» В-клеток памяти (28% – 0,003 x109/л). Количество плазматических клеток оставалось на низком уровне. К двенадцатому месяцу наблюдения после курса комбинированной анти-В-клеточной терапии у пациентки наблюдается медикаментозная клиническая ремиссия СКВ, SLEDAI-2K-2 балла (за счет низкого уровня С3 компонента комплемента). Пациентка продолжает получать преднизолон в дозе 7,5 мг/сутки, лечение ЦФ и БЛМ прекращено (рис. 1, 2, 3, 4).
Пациентка С, 16 лет, поступила в клинику ФГБНУ НИИР им. В. А. Насоновой с диагнозом: «СКВ острого (по началу) течения». В анамнезе: поражение кожи (эритематозные высыпания), суставов (полиартрит, артралгии), гематологические нарушения (изолированная положительная проба Кумбса), иммунологические нарушения (ат к нДНК, снижение уровня С3, С4 компонентов комплемента), АНФ (+). Высокая ативность по SLEDAI 2 К-10 баллов. ИП SLICC/ACR – 0.
С 2012 года стали беспокоить боли в суставах кистей, лучезапястных, плечевых, коленных, голеностопных суставах, в течение трех предшествующих лет – явления фотодерматита. В октябре 2014 года появился мигрирующий артрит мелких суставов кистей, крупных суставов, стойкие эритематозные высыпания в области лица и декольте.
В ноябре 2014 года госпитализирована в клинику ФГБНУ НИИР им. В. А. Насоновой, при обследовании ат к нДНК >300 МЕ/мл, АНФ 1/640h, С3 – 0,37 г/л, С 4 – 0,022 г/л (содержание криопреципитинов , ат-Ro, ат-La, антител к кардиолипину (аКЛ) IgG/IgM, В2 гликопротеину (аB2-ГП) IgG/IgM – в пределах нормы), положительная проба Кумбса (+1, тепловые антитела). Данных за поражение почек, ЦНС, наличия васкулита – не получено. Установлен диагноз СКВ, назначен метипред 12 мг в сутки, ГХ 200 мг в сутки. При определении субпопуляций В-клеток отмечено высокое процентное и абсолютное содержание общей популяции В-лимфоцитов за счет наивных В-лимфоцитов (87,4% – 0,64 x109/л), плазматических клеток (14% – 0,1 x109/л), двойных негативных В-лимфоцитов памяти (9,6% – 0,07 x109/л). В связи с высокой активностью заболевания, нежеланием пациентки принимать цитостатические препараты и увеличивать дозы ГК, инициирована терапия РТМ 500 мг с премедикацией солумедролом 250 мг к третьему месяцу наблюдения. На фоне терапии удалось полностью купировать клинические проявления заболевания, достигнута полная деплеция В-лимфоцитов, SLEDAI-2K 4 балла за счет сохранения минимальной иммунологической активности.
Для того чтобы обеспечить возможность дальнейшего снижения дозы ГК, в апреле 2015 года к лечению был добавлен БЛМ по стандартной схеме, всего выполнено восемь инфузий. К июню 2015 года доза метипреда снижена до 4 мг в сутки. К двенадцатому месяцу наблюдения после курса комбинированной анти В-клеточной терапии у пациентки сохранялась медикаментозная ремиссия, SLEDAI-2K-2 балла (за счет сниженного уровня С3 компонента комплемента – 0,88г/л). Пациентка продолжает получать метипред 4 мг/сутки. К шестому месяцу наблюдалась репопуляция В-лимфоцитов преимущественно за счет «переключенных» (61,9% – 0,007 x109/л), наивных В-лимфоцитов (28,6% – 0,003 x109/л). К девятому месяцу сохранялись высокие значения наивных В-клеток (54% – 0,006 x109/л), а к двенадцатому месяцу возросло количество «непереключенных» (28,1% – 0,003 x109/л) и «двойных негативных» (18,8% – 0,002x109/л) В-клеток памяти с одновременным снижением доли «переключенных» В-лимфоцитов памяти (9,4% – 0,001 x109/л). Количество плазматических клеток оставалось на низком уровне (рис. 1–4).
Пациентка Л, 20 лет, поступила в клинику ФГБНУ НИИР им. В. А. Насоновой с диагнозом: «СКВ, хронического (по началу) течения, поражение кожи («бабочка», эритематозные высыпания, фотосенсибилизация, ливедо), слизистых (хейлит, энантема неба), суставов (артрит), серозных оболочек, иммунологические нарушения (ат к нДНК, снижение уровня С3 компонента комплемента АНФ+)». В анамнезе: конституциональные нарушения (субфебрильная температура, лимфаденопатия) средней степени активности ( SLEDAI 2К-8 баллов). Медикаментозный синдром Иценко-Кушинга. ИП SLICC/ACR = 1 (ангиопатия сетчатки).
Пациентка болеет с марта 2007 года – фотосенсибилизация, «эритема-бабочка», сыпь на плечах, артрит межфаланговых суставов кистей, голеностопных суставов, ливедо нижних конечностей, субфебрилитет, повышенные уровни ат к нДНК, АНФ, ат-Ro, ат-Lа. Установлен диагноз СКВ (без поражения почек, ЦНС). С 2007 года находится на постоянной глюкокортикоидной терапии с максимальной дозой преднизолона 60 мг/сутки, минимальной 15 мг/сутки. При снижении дозы преднизолона до 15 мг/сутки отмечалось обострение кожных проявлений СКВ, гингивит, лимфаденопатия. В качестве базисной терапии получала ГХ 400 мг/сутки (с февраля 2012 года по настоящее время), азатиоприн (январь 2008 года – 50–100 мг/сутки, декабрь 2011 – февраль 2012 года – 50 мг/сутки, с января по декабрь 2013 года – 150 мг/сутки) с недостаточным эффектом, ММ 2г/сутки (январь 2014 года, с 09.04. по 06.2014 года) с недостаточным эффектом, метотрексат 10 мг/неделю (09.14 –01.2015 года) (на фоне лечения отмечалось повышение уровня печеночных ферментов). В 2011 году проводилась пульс-терапия метипредом 1750 мг суммарно. Несмотря на проводимое лечение, наблюдались ежегодные обострения СКВ с преимущественным поражением кожи, суставов, слизистых полости рта. С 2012 года высыпания стали носить полиморфный характер: от мелкопапулезной до крупной сливающейся эритемы с образованием кольцевидных элементов (в области лица, декольте, живота, спины, на руках), что требовало увеличения дозы ГК до 30–60 мг в сутки (в пересчете на преднизолон) в сочетании с различными ЦТ. На фоне приема высоких доз ГК (более 30 мг/сутки) удавалось купировать кожные проявления СКВ.
С 2012 года наблюдается в ФГБНУ НИИР им. В. А. Насоновой. Последнее обострение – с марта 2014 года, когда после перенесенной острой респираторной вирусной инфекции ОРВИ вновь появились эритематозные высыпания >18% площади поверхности тела, энантема полости рта, ливедо нижних конечностей, артрит, периодически лихорадка до 38,5С, отмечались гематологические нарушения (лейкопения). В анализах: ат к нДНК >300 МЕ/мл, АНФ 1/640h+sp, С3 – 0,42 г/л, С4 – 0,06 г/л, ат Ro > 200 Ед/мл, ат La > 200 Ед/мл, СРБ 2,7 мг/л, аКЛ IgG/IgM и волчаночный антикоагулянт в пределах нормы. С учетом длительности приема высоких доз ГК, отсутствием возможности уменьшения дозы ниже 15 мг/сутки, недостаточным эффектом ЦТ и высоким риском развития необратимых органных повреждений у пациентки молодого возраста, в апреле 2014 года решено начать терапию БЛМ из расчета 10 мг на кг массы тела (всего проведено семь инфузий). На фоне терапии клинические проявления СКВ полностью купировать не удавалось: сохранялись и рецидивировали высыпания, регистрировались эпизоды лихорадки, энантемы полости рта, ат к нДНК 42 МЕ/мл, АНФ 1/640, С3 0,59 г/л, С4 0,1 г/л. Продолжала прием метипреда 12 мг/сутки, к терапии добавлен метотрексат (в связи с увеличением содержания печеночных ферментов более чем в три раза выше нормы препарат отменен в январе 2015 года).
В декабре 2014 года в связи с сохраняющейся активностью СКВ и неэффективностью ранее проводимого лечения, было решено инициировать терапию РТМ 1000 мг с последующим продолжением терапии БЛМ по стандартной схеме. При обследовании отмечено невысокое процентное и абсолютное содержание общей популяции В-лимфоцитов (4,4%), наивных В-лимфоцитов (21,1% – 0,64 x109/л), «переключенных» (30,5% – 0,03 x109/л), двойных негативных В-лимфоцитов памяти (44,2% – 0,05 x109/л). Через двенадцать месяцев после начала комбинированной анти-В-клеточной терапии наблюдалось снижение иммунологической активности (уменьшение количества ат к нДНК до 13.9 МЕ/мл, увеличение концентрации С3, С4 компонентов комплемента), нормализация гематологических показателей, достигнута частичная деплеция В-лимфоцитов, уменьшение выраженности высыпаний и энантемы неба. У пациентки сохраняется незначительная активность СКВ SLEDAI-2K. 6 баллов за счет высыпаний, энантемы и сниженного уровня С3 компонета комплемента (С3 – 0,81 г/л), снижена доза ГК с 3 таб/сутки до 1,5 таб/сутки. Обострений СКВ за год наблюдения не отмечалось (рис. 1 – 4).
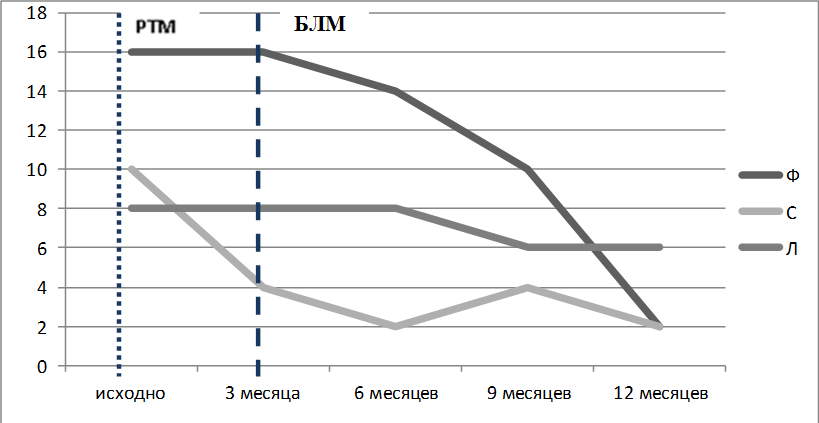
Рисунок 1. Динамика активности СКВ по индексу SLEDAI-2K пациенток Ф, С и Л Короткая пунктирная линия – введение РТМ, длинная пунктирная линия – начало лечения БЛМ
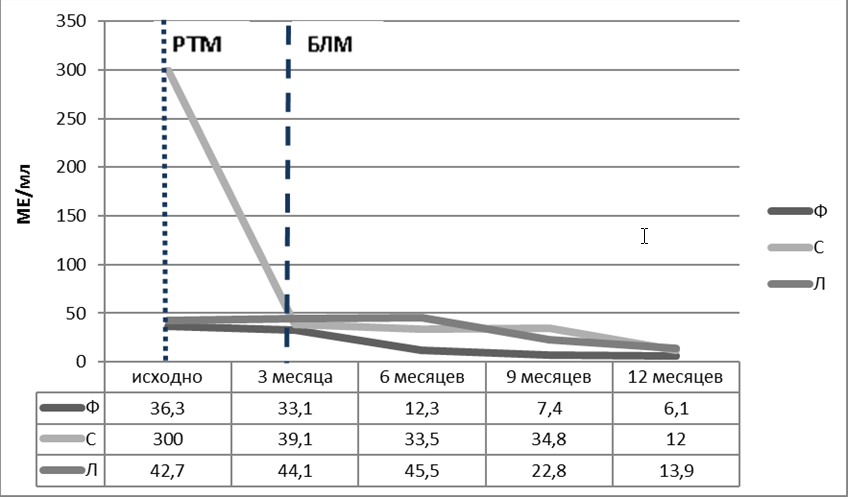
Рисунок 2. Динамика концентрации ат к нДНК в сыворотке крови у пациенток Ф, С и Л Короткая пунктирная линия – введение РТМ, длинная пунктирная линия – начало лечения БЛМРисунок 1. Динамика активности СКВ по индексу SLEDAI-2K пациенток Ф, С и Л Короткая пунктирная линия – введение РТМ, длинная пунктирная линия – начало лечения БЛМ
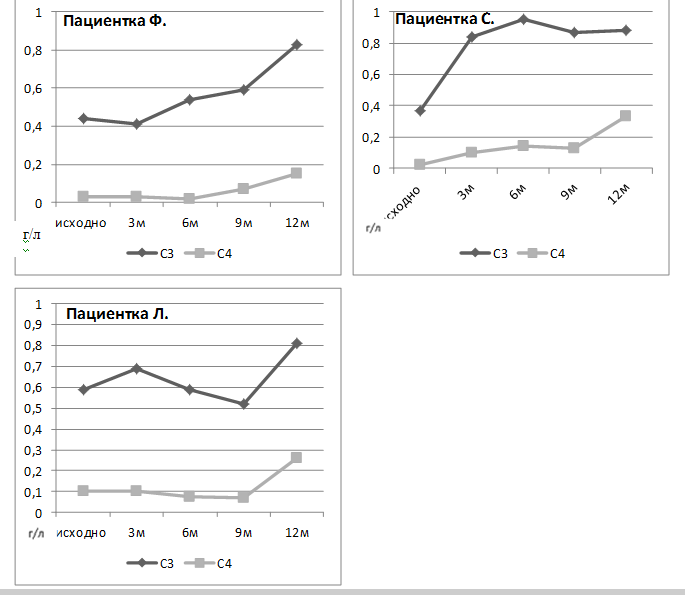
Рисунок 3. Динамика концентрации С3 и С4 компонентов комплемента пациенток Ф, С и Л на фоне двойной анти-В-клеточной терапии
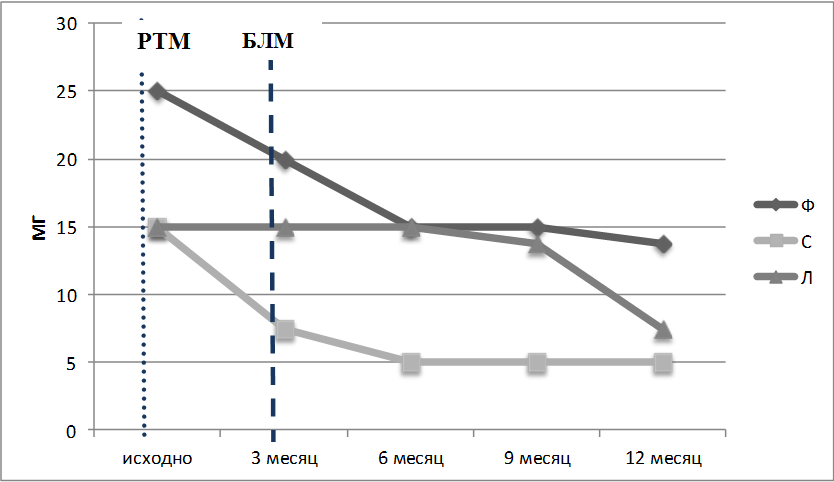
Рисунок 4. Лечение ГК в пересчете на преднизолон за год наблюдения. Короткая пунктирная линия – введение РТМ, длинная пунктирная линия – начало лечения БЛМ
Динамика субпопуляций В-лимфоцитов под влиянием двойной анти-В-клеточной терапии
Изначально количество наивных В-лимфоцитов и субпопуляций короткоживущих плазматических клеток было значительно выше у пациентки С, с дебютом СКВ, которая ранее не получала ГК, цитостатики и ГИБП. Одновременно с этим выявлялась высокая иммунологическая активность. Однако тяжелых органных поражений у данной пациентки не было.
Процентное распределение базальных уровней субпопуляций В-лимфоцитов, в целом, было одинаковым у пациенток Ф и С без предшествующей терапии ГИБП (рис. 5). К третьему месяцу у этих больных достигнута полная деплеция В клеток с последующем их восстановлением через шесть и девять месяцев, преимущественно за счет наивных В-клеток, «переключенных» и «двойных негативных» В-лимфоцитов памяти. А к двенадцатому месяцу помимо вышеперечисленных изменений отмечено увеличение числа «непереключенных» В-лимфоцитов памяти. Количество плазматических клеток в течение всего года наблюдения оставалось низким. Раннее восстановление В-лимфоцитов после полной деплеции (через шесть месяцев) отмечено у пациентки С с высоким базальным числом аутореактивных В-клеток. Уровень восстановленных В-лимфоцитов через год после начала наблюдения не достигал исходных значений (рис. 6, 7).
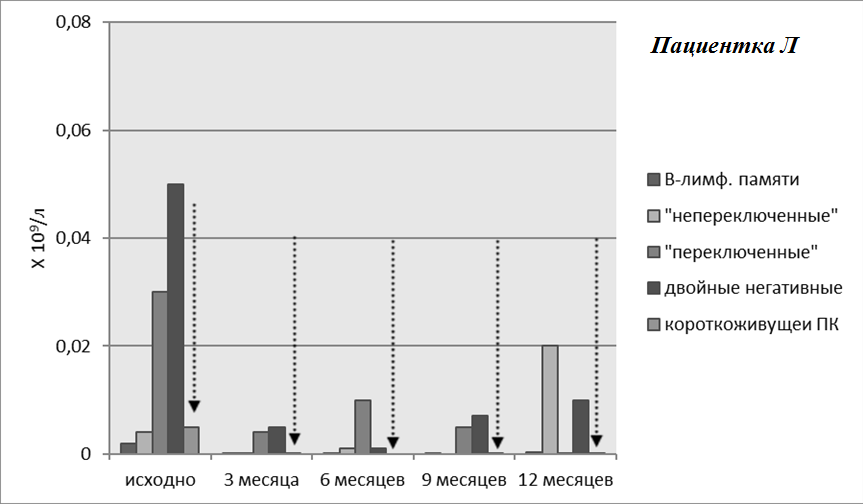
У пациентки Л базальная популяция В-лимфоцитов была ниже, что обусловлено проведением до включения больной в наблюдение годичного курса лечения БЛМ, на фоне которого отмечалась положительная динамика лабораторных показателей без улучшения клинической картины. Несмотря на снижение числа В-клеток, полной их деплеции после одного курса РТМ достигнуть не удалось. Примечательно, что несмотря на проведение активной терапии, на протяжении двенадцати месяцев наблюдения сохранялись эритематозные высыпания и энантема слизистой рта, однако на фоне лечения отмечено уменьшение выраженности симптомов, а также полная нормализация клинических и иммунологических показателей крови.
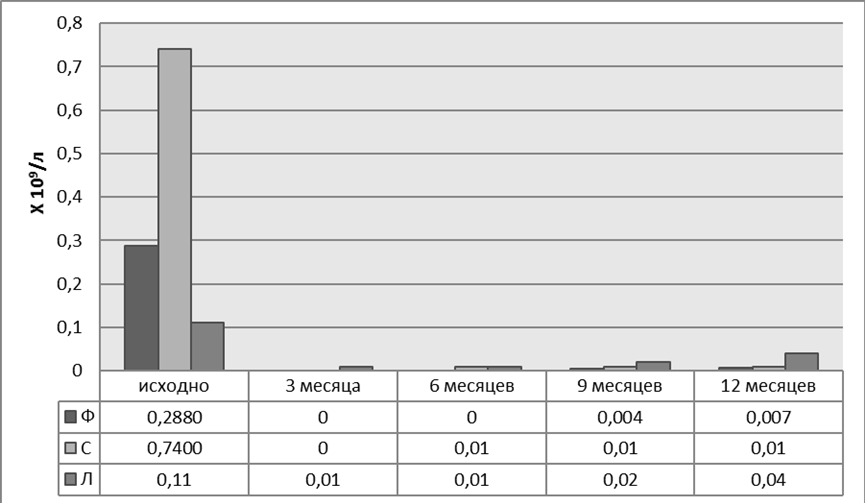
Рисунок 5. Динамика CD 19+ В-лимфоцитов пациенток Ф, С и Л на фоне терапии ГИБП
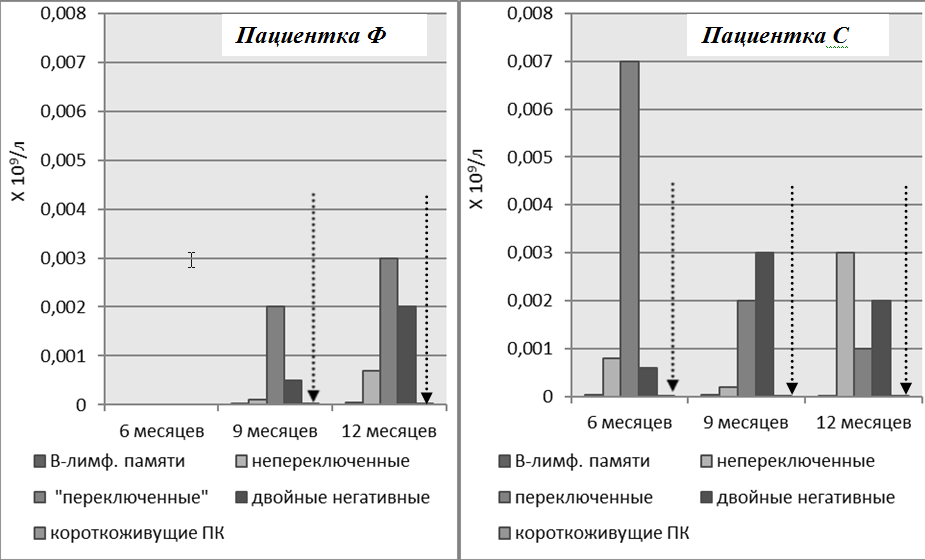
Рисунок 6. Динамика В-лимфоцитов памяти и короткоживущих плазматических клеток через 6–12 месяцев после начала терапии. Пациенты Ф и С. Уровень плазматических клеток после начала репопуляции оставался низким на фоне терапии (обозначен пунктирными стрелками)
 .
.
Рисунок 7. Динамика В-лимфоцитов памяти и плазматических клеток на фоне терапии ГИБП. Пациентка Л. Уровень плазматических клеток после курса РТМ оставался низким на фоне терапии (обозначен пунктирными стрелками)
Обсуждение и заключение
Механизмы действия РТМ и БЛМ различны и направлены на подавление определенных субпопуляций В-лимфоцитов. К РТМ чувствительны преимущественно наивные В-клетки и В-клетки памяти, имеющие на своей поверхности мембранные CD20 антигены. Эффективность такой терапии с иммунологической точки зрения оценивается по уровню и длительности В-клеточной деплеции [15]. Ряд исследований позволили выявить особенности течения заболевания, которые ассоциировались с динамикой уровней субпопуляций В-лимфоцитов. Так было высказано предположение, что раннее восстановление чила В-клеток наблюдается у пациентов с изначально высоким их количеством [16], а репопуляция до определенных уровней отдельных субпопуляций В-лимфоцитов, в частности В-клеток памяти и плазматических клеток, коррелирует с ранним обострением СКВ [17]. Предиктором выраженного снижения концентрации антител к нДНК и увеличения концентрации С3 компонента комплемента у таких пациентов является отсутствие антител к RNP, Sm, Ro, La [18]. Примечательно, что у пациентов, получавших РТМ, одновременно с деплецией В-лимфоцитов через три – четыре месяца в плазме наблюдается существенное увеличение уровня BlyS [19].
БЛМ, блокируя BlyS, воздействует на транзиторные, наивные В-клетки и плазматические клетки, что в свою очередь приводит к подавлению характерной для СКВ В-клеточной гиперреактивности, в частности синтеза аутоантител [20]. Кроме того, блокада BLyS может приводить к снижению выживаемости В-клеток в ростковых центрах лимфоидных органов, дифференцировки В-клеток памяти в аутоантитело-продуцирующие клетки и синтеза провоспалительных цитокинов. Также хочется подчеркнуть, что лечение высокими дозами ГК способствует нормализации уровня BLyS в сыворотке крови. Попытки снижения дозы препарата у части больных могут приводить к рецидиву СКВ за счет увеличения концентрации BlyS. Назначение ингибиторов BlyS позволяет постепенно снизить дозу ГК с минимальным риском обострения заболевания [21].
Таким образом, перекрывающие и дополняющие друг друга механизмы действия РТМ и БЛМ могут способствовать более эффективному подавлению аутореактивных В-клеток, снижению выработки широкого спектра аутоантител, длительному поддержанию достигнутого эффекта.
Поскольку оба ГИБП тем или иным образом направлены на подавление аутореактивных В-лимфоцитов, лечение с последовательным применением РТМ и БЛМ названы двойной анти-В-клеточной терапией.
О предполагаемой эффективности двойной анти-В-клеточной терапии сообщают WeiYu Lin и соавт. [22], которые в экспериментах на (NZB/NZW)F1 мышах после лечения отмечали лучший эффект по сравнению с монотерапией. На основании проведенных исследований высказано предположение, что такая терапия обеспечивает значительное улучшение течения и выживаемости при СКВ за счет наиболее эффективной деплеции тканевых и циркулирующих аутореактивных В-клеток, включая В-клетки маргинальной зоны, плазмобласты и плазматические клетки, что способствует снижению выработки аутоантител и уменьшению инфильтрации почек активированными Т-клетками.
Теоретические предпосылки возможности комбинации РТМ и БЛМ при СКВ уже находят свое применение в реальной клинической практике. Так, Kraaij T и Huizinga TW [23] представили два клинических случая, где пациентам с явлениями люпус-нефрита (суточная протеинурия 8 и 9,8 г/сутки соответственно) была выполнена инфузия РТМ с последующим назначением БЛМ. На этом фоне было достигнуто уменьшение протеинурии соответственно (0,9 и 1,5 г/сутки), концентрации антител к дс-ДНК, увеличение С3,С4 компонентов комплемента и стойкое снижение количества аутореактивных В-клеток. На протяжении последующих двенадцати месяцев наблюдения сохранялась минимальная активность заболевания (SLEDAI 6-4). В другом исследовании De Vita S. и соавт. [24] продемонстрировали высокую эффективность комбинации последовательных курсов РТМ и БЛМ у больного с синдромом Шегрена, осложненного лимфомой и криоглобулинемическим язвенно-некротическим васкулитом. Стойкая регрессия лимфомы и полное купирование васкулита сохранялось в течение трех с половиной лет наблюдения, отмечено исчезновение криоглобулинов, нормализация уровня РФ, С4 компонента комплемента и BAFF в сыворотке крови. Комбинированная терапия у этой пациентки не сопровождалась неблагоприятными реакциями.
Существующие данные пока не могут полностью отразить преимущества и недостатки такого лечения. Тем полезнее рассматривать каждый случай применения двойной анти-В-клеточной терапии у больных СКВ с различными вариантами течения заболевания.
Несмотря на различия в истории развития, тяжести заболевания, двойная анти-В-клеточная терапия показала высокую эффективность у наших пациентов: наблюдалось улучшение клинической картины, лабораторных маркеров активности СКВ, в частности повышение концентрации С3-, С4-компонентов комплемента, стойкое снижение концентрации антител к нДНК. У больной Ф с проявлениями васкулита наблюдалась инфузионная реакция через сутки после введения РТМ, которая была купирована внутривенным введением ГК. Дальнейшая терапия этой пациентки с применением БЛМ и короткого курса цитостатических препаратов, на фоне уже достигнутой на РТМ деплеции аутореактивных В-лимфоцитов, полностью купировала клинико-лабораторные симптомы СКВ. Переносимость двойной анти-В-клеточной терапии после присоединения БЛМ была удовлетворительной у всех пациенток. В динамике инфузионных реакций не наблюдалось, тяжелых инфекций также не зарегистрировано. В течение года ни у одного больного не было признаков обострения, в результате чего нам удалось снизить дозу ГК у всех пациентов до 1,5 таблетки в сутки к 14–15 месяцу после терапии ГИБП. Уровень восстановленных В-лимфоцитов через год после начала наблюдения не достигал исходных значений. Несмотря на заметное увеличение числа В-лимфоцитов памяти, к 6–9 месяцу после курса лечения РТМ количество плазматических клеток оставалось низким.
На основании полученных результатов можно предположить, что двойная анти-В-клеточная терапия ГИБП:
— обеспечивает значительное снижение активности СКВ;
— снижает риск обострения заболевания;
— способствует быстрому снижению дозы ГК, уменьшая тем самым риск развития необратимых органных повреждений;
— обеспечивает стойкое снижение числа аутореактивных В-лимфоцитов, в частности плазматических клеток, благодаря перекрывающим и дополняющим друг друга механизмам действия РТМ и БЛМ;
— способствует быстрой и стойкой нормализации лабораторных маркеров активности заболевания (концентрации антител к нДНК, С3,С4 компонентов комплемента).
Таким образом, применение одновременно двух ГИБП в лечении пациентов с активной СКВ является новым перспективным методом терапии, способствующим быстрому подавлению обострения заболевания и улучшению качества жизни пациентов.
Прозрачность исследования
Исследование не имело спонсорской поддержки. Авторы несут полную ответственность за предоставление окончательной версии рукописи в печать.
Декларация о финансовых и других взаимоотношениях
Все авторы принимали участие в разработке концепции статьи и в написании рукописи. Окончательная версия рукописи была одобрена всеми авторами. Авторы не получали гонорар за статью.
Литература
Vasoo S., Hughes GRV. Perspectives on the changing face of lupus mortality. Autoimmun Rev. 2004; 3: 415–417.
Андрианова И. Л., Иванова М. М.. Ранний индекс повреждения у больных системной красной волчанкой. Научно-практическая ревматология, 2005; 5:19–22.; [Andrianova I. L., Ivanova M. M. Rannij indeks povrezhdenija u bol'nyh sistemnoj krasnoj volchankoj. Nauchno-prakticheskaja revmatologija, 2005; 5:19–22].
Sutton EJ, Davidson JE, Bruce IN. The systemic lupus international collaborating clinics (SLICC) damage index: a systematic literature review. Semin Arthritis Rheum. 2013 Dec; 43 (3): 352–61 doi:10.1016/j. semarthrit. 2013.05.003.
Van Vollenhoven RF, Mosca M, Bertsias G et al. Treat-to-target in systemic lupus erythematosus: recommendations from an international task force. Ann Rheum Dis. 2014; 73 (6): 958–67 doi: 10.1136/annrheumdis – 2013–205139.
Соловьев С. К., Асеева Е. А., Попкова Т. В. и др. Стратегия лечения системной красной волчанки «до достижения цели» (Treat-to-Target SLE). Pекомендации международной рабочей группы и комментарии российских экспертов. Научно-практическая ревматология. 2015; 53 (1): 9–16 [Solov'ev SK, Aseeva EA, Popkova TV i dr. Strategija lechenija sistemnoj krasnoj volchanki «do dostizhenija celi» (Treat-to-Target SLE). Pekomendacii mezhdunarodnoj rabochej gruppy i kommentarii rossijskih jekspertov. Nauchno-prakticheskaja revmatologija. 2015; 53 (1): 9–16].
L. Lan, F. Han, J. Chen. Efficacy and safety of rituximab therapy for systemic lupus erythematosus: a systematic review and meta-analysis. J Zhejiang Univ Sci B. 2012 September; 13 (9): 731–744; PMID: 22949364.
М. Э. Цанян, С. К. Соловьев, А. А. Новиков, и соавт. Эффективность терапии ритуксимабом у больных рефрактерной к стандартной терапии системной красной волчанкой при длительном динамическом наблюдении. Научно-практическая ревматология, 2014; 52 (2): 159–168 [M. Je. Canjan, S. K. Solov'ev, A. A. Novikov, i soavt., Jeffektiv-nost' terapii rituksimabom u bol'nyh refrakternoj k standartnoj terapii sistemnoj krasnoj volchankoj pri dlitel'nom dinamicheskom nabljudenii. Nauchno-prakticheskaja revmatologija, 2014; 52 (2): 159–168].
FDA approves Benlysta to treat lupus. [Last accessed on 2011 Mar 28]. Available from: http://www.fda.gov/NewsEvents/Newsroom/Press Announcements/Ucm246489.htm.
Асеева Е. А., Соловьев С. К., Насонов Е. Л. Генно-инженерные биологические препараты в терапии системной красной волчанки. Современная ревматология, 2013, 3, 1–8; [Aseeva E. A., Solov'ev S. K., Nasonov E. L. Genno-inzhenernye bio-logicheskie preparaty v terapii sistemnoj krasnoj volchanki. Sovremennaja revmatologija, 2013, 3, 1–8].
Асеева Е. А., Соловьев С. К., Меснянкина А. А. и др. Опыт применения белимумаба у больных системной красной волчанкой. Научно-практическая ревматология. 2015; 53 (3): 329–335; [Aseeva E. A., Solov'ev S. K., Mesnjankina A. A. i dr. Opyt primenenija belimumaba u bol'nyh sistemnoj krasnoj volchankoj. Nauchno-prakticheskaja revmatologija. 2015; 53 (3): 329–335].
Ginzler E.,Wallace D., Merill J. Disease Control and safety of Belimumab plus standard therapy over 7 years in patients with systemic lupus erythematosus. The J.of Rheumatology, 2014, 41:2, 300–9.
Lavie F., Miceli-Richard C., Ittah M, et al., Increase of B cell-activating factor of the TNF family (BAFF) after rituximab treatment: insights into a new regulating system of BAFF production. Ann Rheum Dis. 2007; 66 (5): 700–3.
L. M. Carter, D. A. Isenberg, M. R. Ehrenstein. Elevated Serum BAFF Levels Are Associated With Rising Anti-Double-Stranded DNA Antibody Levels and Disease Flare Following B Cell Depletion Therapy in Systemic Lupus Erythematosus. Arthritis & Rheumatism 2013; 65 (10): 2672–2679 DOI: 10.1002/art. 38074.
Супоницкая Е. В., Алексанкин А. П., Александрова Е. Н. и др. Определение субпопуляций В-лимфоцитов периферической крови методом проточной цитофлуорометрии у здоровых лиц и больных ревматическими заболеваниями. Клиническая лабораторная диагностика, 2015, 60 (6), 30–33; [Suponickaja E. V., Aleksankin A. P., Aleksandrova E. N. i dr. Opredelenie sub-populjacij V-limfocitov perifericheskoj krovi metodom protochnoj citofluorometrii u zdorovyh lic i bol'nyh revmaticheskimi zabolevanijami. Klinicheskaja laboratornaja dia-gnostika, 2015, 60 (6), 30–33].
Александрова Е. Н., Новиков А. А., Соловьев С. К. и др. В-клетки при аутоиммунных ревматических заболеваниях. Насонов Е. Л. – редактор. Анти-В-клеточная терапия в ревматологии: фокус на ритуксимаб. Москва; ИМА-ПРЕСС 2012; с. 8–45; [Alexandrova E. N., Novikov A. A., Soloviev S. K. et al. V-kletki pri auto-immunnyh revmatiche-skih zabolevanijah. Nasonov E.L. – redaktor. Anti-V-kletochnaja terapija v revmatologii: fokus na rituksimab. Moskva; IMA-PRESS 2012; с. 8–45].
Vallerskog T, Gunnarsson I, Widhe M, et al.Treatment with rituximab affects both the cellular and the humoral arm of the immune system in patients with SLE. Clin Immunol. 2007; 122: 62–74. Epub 2006 Oct 13.
Vital EM, Dass S, Buch MH, et al. B Cell Biomarkers of Rituximab Responses in Systemic Lupus Erythematosus. Arthritis Rheum. 2011; 63: 3038–3047. DOI: 10.1177/0961203309350752.
Tew GW, Rabbee N, Wolslegel K. Baseline autoantibody profiles predict normalization of complement and anti-dsDNA autoantibody levels following rituximab treatment in systemic lupus erythematosus. Lupus 2010; 19: 146–57. DOI: 10.1177/0961203309350752. Epub: 2009 Nov 27.
Vallerskog T, Heimbürger M, Gunnarsson I, et al. Differential effects on BAFF and APRIL levels in rituximab-treated patients with systemic lupus erythematosus and rheumatoid arthritis. Arthritis Res Ther. 2006; 8: 167.
Bekar KW, Owen T, Dunn R, et al. Prolonged effects of short-term anti-CD20 B cell depletion therapy in m И Jacobi AM, Huang W, Wang T, et al. Effect of long-term belimumab treatment on B cells in systemic lupus erythematosus: extension of a phase II, double-blind, placebo-controlled, dose-ranging study. Arthritis Rheum. 2010; 62 (1): 201–10. DOI: 10.1002/art. 27189.
Насонов Е. Л., Решетняк Т. М., Денисов Л. Н., Соловьев С. К., и др. Белимумаб: прогресс в лечении системной красной волчанки. Научно-практическая ревматология 2012; 54 (5): 13–19; [E. L. Nasonov, T. M. Reshetnjak, S. K. Soloviev. Belimumab: progress v lechenii sistemnoj krasnoj volchanki. Nauchno-prakticheskaja revmatologija 2012; 54(5): 13–19].
WeiYu Lin, Seshasayee D, Lee WP, et al. Dual B Cell Immunotherapy Is Superior to Individual Anti-CD20 Depletion or BAFF Blockade in Murine Models of Spontaneous or Accelerated Lupus. Arthritis Rheum. 2015; 67 (1): 215–224. DOI: 10.1002/art. 38907.
Kraaij T, Huizinga TW, Rabelink TJ, et al. Belimumab after rituximab as maintenance therapy in lupus nephritis. Rheumatology. 2014; 53: 2122–2124. DOI: 10.1093/rheumatology/keu369. Epub 2014 Sep. 8.
De Vita S., Quartuccio L., Salvin S et al. Sequential therapy with belimumab followed by rituximab in Sjögren's syndrome associated with B-cell lymphoproliferation and overexpression of BAFF: evidence for long-term efficacy. Clin Exp Rheumatol. 2014; 32 (4): 490–4.

