Гипераммониемия у пациентов с заболеванием печени на доцирротической стадии: возможно ли это? Предварительные результаты исследования СМАРТ РАДАР
Резюме
Цель исследования
Оценить влияние перорального приема L-
Материал и методы
В исследование включено 42 пациента — мужчин в возрасте от 25 до 45 лет, водителей со стажем не менее трех лет, признанных виновными в 3–4 ДТП за последние три года. У всех пациентов диагностирован хронический гепатит С (генотип 1) с минимальной или низкой активностью аминотрансфераз и минимальным фиброзом печени. Исключены заболевания, которые могли бы повлиять на совершение ДТП, а также внешние факторы (состояние автомобиля, дорожного покрытия, погодные условия). Терапия LОLА в дозе 9 г в день проводилась двухмесячными циклами с двухмесячным перерывом, к настоящему времени общей продолжительностью пять месяцев. Ежемесячно выполнялись биохимический анализ крови, определение концентрации иона аммония в крови, психометрические тесты.
Результаты
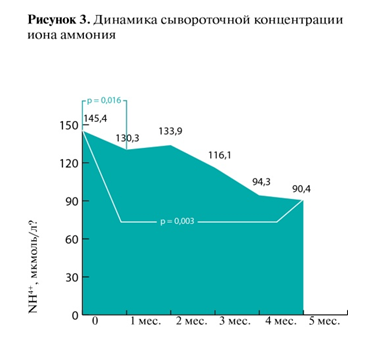
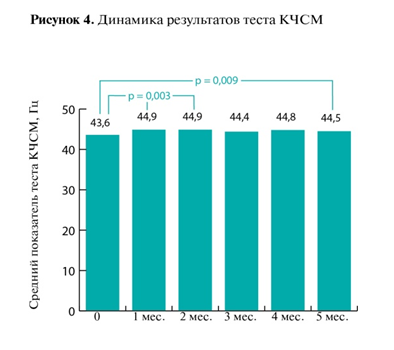
Концентрация иона аммония значимо снижалась уже через месяц после начала приема LOLA (с 145,4 мкмоль/л до 130,3 мкмоль/л, р = 0,016), сохраняя стойкую тенденцию к снижению в течение терапии до достижения среднего уровня 90,4 мкмоль/л (р = 0,003) к шестому месяцу. Результаты теста критической частоты слияния мельканий достоверно улучшались к окончанию первого курса LOLA (р = 0,003), сохраняясь на достигнутом уровне на протяжении терапии. Результаты теста связи чисел также значимо улучшались к концу первого месяца лечения (р < 0,001) с сохранением тенденции на фоне последующих курсов. За указанный период наблюдения ДТП по вине включенных в исследование лиц, согласно данным ГИБДД, отмечено не было.
Выводы
Интермиттирующая терапия LOLA у пациентов с хроническим заболеванием печени на доцирротической стадии обусловливает быстрое снижение концентрации иона аммония в крови и значимое улучшение показателей психометрических тестов.
Результаты множества исследований — как экспериментальных, так и клинических — дают основание постулировать роль аммиака в качестве одного из важнейших нейротоксических метаболитов. Как известно, наиболее значительное его количество образуется вследствие дезаминирования аминокислот в печени; в качестве дополнительных источников могут выступать мышцы, почки и пищеварительный тракт. Являясь основным источником аммиака, печень в то же время служит главным местом его обезвреживания за счет синтеза мочевины в функционирующем в перипортальных гепатоцитах орнитиновом цикле. Меньшая часть аммиака участвует в синтезе глутамина в перивенозных гепатоцитах, мышцах и головном мозге [1, 3, 4].
Механизм токсического действия аммиака на мозг и организм в целом, очевидно, связан с влиянием его на несколько функциональных систем [4, 8].
α-Кетоглутарат + NADH + Н+ + NH3 → Глутамат + NAD+
Уменьшение концентрации α-
К угнетению реакций трансаминирования и, следовательно, синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.).
К снижению концентрации метаболитов цитратного цикла, что вызывает ускорение реакции синтеза оксалоацетата из пирувата, сопровождающейся интенсивным потреблением СО2. Усиленное образование и потребление диоксида углерода при гипераммониемии особенно характерны для клеток головного мозга.
Глутамат + NH3 + АТФ → Глутамин + АДФ + Н3Р04
Накопление глутамина в клетках нейроглии приводит к повышению осмотического давления в них, набуханию астроцитов и в больших концентрациях может вызвать отек мозга. Снижение концентрации глутамата нарушает обмен аминокислот и нейромедиаторов, в частности синтез γ-аминомасляной кислоты — основного тормозного медиатора. Наконец, избыток иона аммония в крови способен нарушать трансмембранный перенос одновалентных катионов Na+ и К+, конкурируя с ними за ионные каналы, что также влияет на проведение нервных импульсов.
Латентная печеночная энцефалопатия (ЛПЭ), обозначаемая так же, как минимальная, при помощи специальных методов может быть диагностирована у 30–85% больных циррозом, то есть представляет собой наиболее частое осложнение заболеваний печени вне зависимости от этиологии [9]. Важнейшее
Вместе с тем возникает весьма важный вопрос: могут ли начальные стадии болезней печени сопровождаться нарушением дезинтоксикации аммиака с соответствующими последствиями? Хотя теоретически такой вариант не исключен, однозначный ответ на него в литературе отсутствует.
В январе 2013 года инициировано открытое сравнительное контролируемое моноцентровое клиническое исследование по изучению влияния L-
Цель исследования: оценить влияние перорального приема LОLА на частоту ДТП у лиц с заболеванием печени на доцирротической стадии.
Задачи исследования
Первичная: определить изменение концентрации иона аммония и показателей психометрических тестов на фоне терапии LОLА у исследуемой группы пациентов.
Вторичные:
оценить наличие и выраженность психомоторных нарушений у водителей — виновников ДТП;
выявить связь зарегистрированной ЛПЭ с наличием заболевания печени на доцирротической стадии;
определить связь наличия ЛПЭ с частотой совершения ДТП у опытных водителей;
выявить изменения в частоте совершения ДТП на фоне терапии LОLА.
Пациенты и методы исследования
Критерии включения:
- мужчина — виновник 3–4 ДТП за последние три года;
- возраст от 25 до 45 лет;
- стаж вождения не менее трех лет;
- хронический гепатит С, генотип 1, с минимальным фиброзом;
- удовлетворительное состояние транспортного средства в момент совершения всех ДТП (согласно данным ГИБДД);
- удовлетворительные дорожные условия в момент совершения всех ДТП (согласно данным ГИБДД).
Критерии исключения:
- совершение ДТП в первые два года активного вождения;
- болезненное состояние в момент совершения всех ДТП (лихорадка, предшествующая психологическая травма, прием психотропных лекарственных препаратов, бессонница, депрессия, наблюдение у психиатра или невролога);
- алкогольное, наркотическое опьянение в момент всех совершенных ДТП (по результатам
судебно-медицинской экспертизы); - анамнестические указания о наличии до совершения ДТП тяжелой
черепно-мозговой травмы, острого и преходящего нарушения мозгового кровообращения, болезни Меньера, хронических головных болей, глаукомы и других заболеваний, которые могли явиться прямой или косвенной причиной совершения ДТП, и при этом незафиксированные в медицинской справке водителя транспортного средства.
Испытуемые, давшие письменное согласие на участие в исследовании, соответствующие критериям отбора, проходили предварительное тестирование, включавшее:
- оценку концентрации внимания, памяти, интеллекта, выявление нарушений счета, поведения, координации движений;
- осмотр врачом в ходе выполнения тестов (настроение, двигательная активность, доступные осмотру кожные покровы и слизистые);
- определение критической частоты слияния мельканий (КЧСМ).
Терапия LОLА в дозе 9 г в день (однократно утром) проводилась двухмесячными циклами с двухмесячным перерывом общей продолжительностью 12 месяцев. Ежемесячно выполнялись общий осмотр пациентов, биохимический анализ крови, определение концентрации иона аммония в крови, психометрические тесты.
Скрининговое обследование и методы контроля эффективности терапии:
- жалобы, объективный осмотр пациента;
- общий анализ крови;
- биохимический анализ крови (АсАТ, АлАТ, ГГТП, ЩФ, альбумин, билирубин + фракции, глюкоза, холестерин, ЛПНП, ЛПВП, триглицериды, креатинин);
- HBsAg,
анти-HBcore ,анти-HCV ,анти-HIV ; - HCV РНК, определение генотипа HCV;
- коагулограмма (МНО, протромбиновый индекс);
- гормоны щитовидной железы (ТТГ, Т4 свободный, антитела к тиреопероксидазе);
- маркеры тезаурисмозов (церулоплазмин, ферритин, α
1-антитрипсин ); - α-фетопротеин;
- концентрация иона аммония в венозной крови с помощью спектрофотометра BECKMAN DU Series 520 энзиматическим методом (Германия);
- определение КЧСМ с помощью аппарата Hepatonorm Analyzer 2003 (Германия);
- тест связи чисел (ТСЧ);
- пункционная биопсия печени.
В исследование к настоящему времени включено 42 пациента, инфицированных генотипом 1 HCV, с минимальной или низкой активностью аминотрансфераз. Средний возраст составил 35,8 ± 6,5 лет. Индекс фиброза по данным гистологического исследования у всех больных — F1 по шкалам METAVIR и Ishak.
Результаты
В настоящей статье рассматриваются предварительные результаты исследования за пять месяцев.
Клинические и биохимические показатели
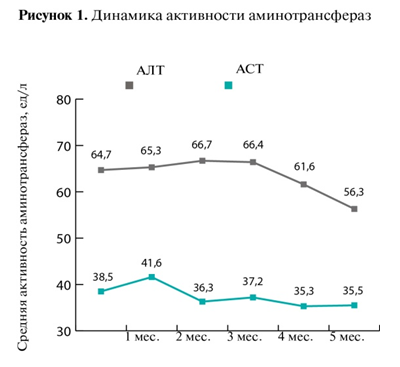
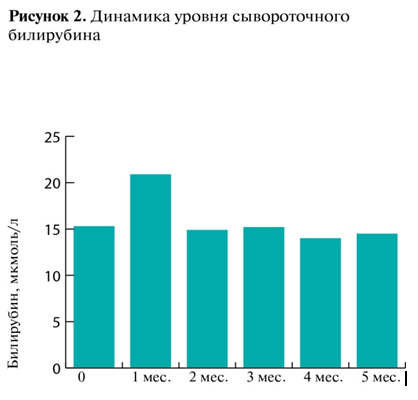
Интермиттирующий пероральный прием LOLA хорошо переносился всеми пациентами. Со стороны общего анализа крови и основных биохимических параметров изменений не отмечалось. К моменту окончания терапии выявлена тенденция к снижению активности АлАТ (рис. 1), не достигшая, однако, статистически достоверного отличия от исходного уровня. Концентрация сывороточного билирубина несколько возрастала после первого курса, возвращаясь затем к первоначальной позиции (рис. 2).
Ион аммония
Концентрация иона аммония значимо снижалась уже через месяц после начала приема LOLA (с 145,4 мкмоль/л до 130,3 мкмоль/л, р = 0,016), сохраняя стойкую тенденцию к снижению в течение терапии до достижения среднего уровня 90,4 мкмоль/л (р = 0,003) к шестому месяцу (рис. 3).
Психометрические тесты
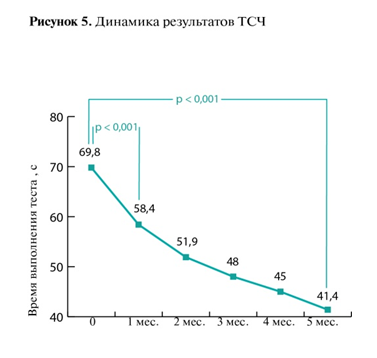
Результаты теста КЧСМ достоверно улучшались к окончанию первого курса LOLA (р = 0,003), сохраняясь на достигнутом уровне на протяжении терапии (рис. 4). Результаты ТСЧ также значимо улучшались к концу первого месяца лечения (р < 0,001), с сохранением тенденции на фоне последующих курсов (рис. 5).
ДТП
За указанный период наблюдения ДТП по вине включенных в исследование лиц, согласно данным ГИБДД, отмечено не было.
Обсуждение
Связь ЛПЭ с ДТП у опытных водителей изучена и описана в литературе [5, 6, 10]. Принципиальным отличием нашего исследования от проведенных ранее служит изучение связи биохимических причин снижения реакции в экстремальных ситуациях и попытка медикаментозного воздействия на эти причины у пациентов с минимальными изменениями печени. Именно поэтому группа испытуемых была сформирована из лиц с хроническим гепатитом С с низкой биохимической и гистологической активностью и минимальным фиброзом. В процессе отбора пациентов исключены превходящие факторы, которые могли бы повлиять на совершение водителем ДТП — заболевания, влияющие на реакцию, алкогольное или наркотическое опьянение, малый стаж вождения, плохое состояние дорожного покрытия
Прием LOLA в дробном режиме — два месяца через два месяца — позволял осуществлять контроль сохранения эффекта терапии во время перерывов.
Влияние терапии LOLA на биохимические показатели было минимальным, однако наблюдалась тенденция к снижению активности АлАТ, проявившаяся к моменту окончания терапии. Ранее публиковались данные о возможном гепатопротективном эффекте LOLA, проявлявшемся в улучшении биохимических показателей у больных с хронической патологией печени [2]. Не исключено, что указанный эффект обусловлен обсуждавшимся выше универсальным токсическим действием аммиака.
Выраженное падение сывороточной концентрации иона аммония представляет собой, на наш взгляд, весьма важный эффект LOLA, представляющий его основной механизм действия — ускорение процессов дезинтоксикации аммиака [2, 3, 7]. Именно он наиболее логично объясняет улучшение результатов психометрических тестов и, возможно, обеспечение безопасности вождения автомобиля.
Изменение результатов двух психометрических тестов — КЧСМ и ТСЧ — на фоне применения препарата было различным, хотя и с явной положительной динамикой в обоих случаях. Тогда как показатели КЧСМ улучшались в начале терапии LOLA с последующей стабилизацией на достигнутом уровне, показатели ТСЧ продолжали улучшаться в течение всего периода наблюдения. Однозначно объяснить этот феномен затруднительно. Следует учитывать, что ТСЧ представляет собой довольно грубый оценочный инструмент ЛПЭ, который, однако, ввиду простоты выполнения широко используется в диагностических целях [7, 9].
Таким образом, на основании предварительных результатов исследования можно предположить, что прием LOLA способствует снижению концентрации иона аммония в крови и улучшению психомоторных реакций. Эти обстоятельства могут объяснять предотвращение совершения ДТП опытными водителями, которые ранее неоднократно выступали в роли их виновников.
Выводы
Интермиттирующая терапия LOLA у пациентов с хроническим заболеванием печени на доцирротической стадии обусловливает быстрое снижение концентрации иона аммония в крови.
На фоне применения LOLA отмечено статистически значимое улучшение показателей психометрических тестов, причем изменения наблюдаются уже через один месяц приема LOLA.
Терапия LOLA хорошо переносится пациентами.
Литература
1. Буеверов
2. Грюнграйф К.,
3. Плотникова
4. Северин
5. Amodio P., Montagnese S., Merkel C. et al. Attention: Minimal hepatic encephalopathy and road accidents // Hepatology. — 2012. — Vol. 55. — P. 985–987.
6. Bajaj J. S., Hafeezullah M., Zadvornova Y. et al. The effect of fatigue on driving skills in patients with hepatic encephalopathy // Am. J. Gastroenterol. — 2009. — Vol. 104. — P. 898–905.
7. Blanco Vela C.I., Poo Ramírez
8. Butterworth R. F., Norenberg M. D., Felipo
9. Wang J. Y., Zhang N. P., Chi B. R. et al. Prevalence of minimal hepatic encephalopathy and quality of life evaluations in hospitalized cirrhotic patients in China // World J. Gastroenterol. — 2013. — Vol. 19. — P. 4984–4491.
10. Wein C., Koch H., Popp B. et al. Minimal hepatic encephalopathy impairs fitness to drive // Hepatology. — 2004. — Vol. 39. — P. 739–745.
11. D’Antiga L, Dacchille P, Boniver C, Poledri S, Schiff S, Zancan L, Amodio P. Clues for minimal hepatic encephalopathy in children with noncirrhotic portal hypertension. J Pediatr Gastroenterol Nutr. 2014 Dec; 59 (6): 689–94.
12. Tiberi O, Tognarelli JM, Cook NA, Crossey MM, Dhanjal NS,
13. Ennaifer R, Cheikh M, Hefaiedh R, Romdhane H, Ben Nejma H, Hadj NB.Minimal hepatic encephalopathy: a better diagnostic to improve prognostic]. Presse Med. 2014 May; 43 (5): e 127–33.
Другие публикации авторов этой статьи
Цель обзора — представить сравнительную характеристику разных производных

